化學(xué)方程式書(shū)寫(xiě)計算步驟及配平技巧大全
化學(xué)方程式是初中化學(xué)的核心知識,所有的計算和定量分析也都圍繞著(zhù)化學(xué)方程式展開(kāi)。那么化學(xué)方程式書(shū)寫(xiě)計算步驟是怎樣的?化學(xué)方程式又該如何配平呢?為了方便大家閱讀,我們將兩篇文章匯總到一篇,讓大家一次學(xué)好化學(xué)方程式。

一、初中化學(xué)方程式的書(shū)寫(xiě)步驟
(1)寫(xiě):正確寫(xiě)出反應物、生成物的化學(xué)式
(2)配:配平化學(xué)方程式
(3)注:注明反應條件
(4)標:如果反應物中無(wú)氣體(或固體)參加,反應后生成物中有氣體(或固體),在氣體(或固體)物質(zhì)的化學(xué)式右邊要標出“↑”(或“↓”).若有氣體(或固體)參加反應,則此時(shí)生成的氣體(或固體)均不標箭頭,即有氣生氣不標“↑”,有固生固不標“↓”
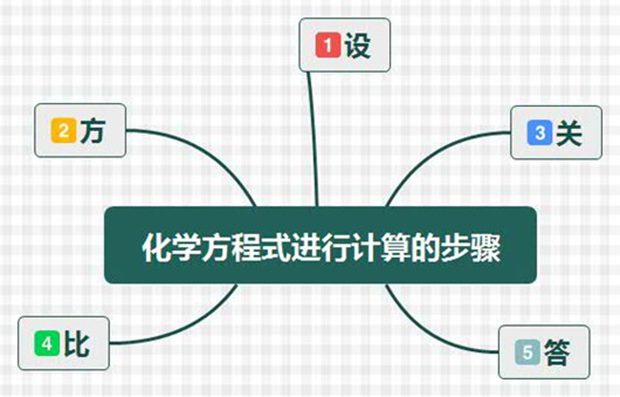
二、根據初中化學(xué)方程式進(jìn)行計算的步驟
(1)設:根據題意設未知量
(2)方:正確書(shū)寫(xiě)有關(guān)化學(xué)反應方程式
(3)關(guān):找出已知物、待求物的質(zhì)量關(guān)系
(4)比:列出比例式,求解
(5)答:簡(jiǎn)要的寫(xiě)出答案
三、根據初中化學(xué)方程式進(jìn)行計算的步驟
最小公倍數法
本法也是配平化學(xué)反應方程式慣用的方法,通常用于較簡(jiǎn)單的化學(xué)方程式的配平,或者作為配平復雜反應的輔助方主。
運用此法一般可按下述步驟去進(jìn)行:
具體步驟:
1.首先,找出反應式左右兩端原子數最多的某一只出現一次的元素,求出它們的最小公倍數。
2,其次,將此最小公倍數分別除以左右兩邊原來(lái)的原子數,所得之商值,就分別是它們所在化學(xué)式的系數。
3.然后,依據已確定的物質(zhì)化學(xué)式的系數、推導并求出它化學(xué)式的系數,直至將方程式配平為止。
4.最后,驗證反應式。配平是否正確。
例題
試配平磁鐵礦(Fe3O4)與鋁粉共燃的反應方程Fe3O4十Al→Fe十Al2O3
(1)該反應氧原子數較多且在兩邊只出現一次,故先求出兩邊氧原子數的最小公倍數:4×3=12。
(2)根據質(zhì)量守恒定律,要使反應式左右兩邊的氧原子數相等,Fe3O4的系數必須為3(12/4),AI2O3的系數必須為4(12/3)即:3Fe3O4十A1→Fe十4A12O3
(3)再配Fe和AL原子。由已配得的3Fe3O4和4Al2O3可知,Fe和Al的系數分別為9和8時(shí),左右兩邊的Fe和Al的原子數才相等,故有:3Fe3O4+8Al=9Fe+4Al2O3
(4)最后檢驗,得完整的化學(xué)方程式為:3Fe3O4+8A=9Fe+4Al2O3
奇數配偶數法
用奇數配偶數法去配平化學(xué)反應方程式的原理是:
一、兩個(gè)奇數或兩個(gè)偶數之和為偶數;奇數與偶數之和則為奇數——簡(jiǎn)稱(chēng)加法則。奇數與偶數或兩個(gè)偶數之積為偶數;兩個(gè)奇數之積則仍為奇數——簡(jiǎn)稱(chēng)乘法則。
二、依質(zhì)量守恒定律,反應前后各元素的原子總數相等。
其配平方法可按以下步驟進(jìn)行:
具體步驟:
1.找出化學(xué)反應式左右兩邊出現次數較多的元素,且該元素的原子個(gè)數在反應式左右兩邊有奇數也有偶數;
2.選定含該元素奇數個(gè)原子的化學(xué)式,作為配乎起點(diǎn),選配適當系數,使之偶數化;
3.由已推得的系數,來(lái)確定其它物質(zhì)的系數。
4.最后,驗證方程式是否正確。
例題
配平FeS2十O2→Fe2O3十SO2
(1)從反應方程式可知,氧元素在兩邊出現的次數較多,且其原子個(gè)數在兩邊有奇數亦有偶數。
(2)反應式左邊有O2,由“乘法則”可知,其系數無(wú)論為何,O原子總數必為偶,而由“加法則”可知,要使右邊O原子總數亦為偶,就必須給右邊含奇數個(gè)氧原子的Fe2O3系數選配2,使之偶數化,則:FeS2十O2→2 Fe2O3十SO2
(3)由已確定的系數,推出與此有關(guān)的其它物質(zhì)的系數。反應式右邊有4個(gè)Fe原子,故左邊FeS2的系數須配4,則:4FeS2十O2→2 Fe2O3十SO2,然后以左邊的S原子數,推得右邊應有8SO2,即:4FeS2十O2→2 Fe2O3十8SO2,最后配平O原子,當左邊有11O2時(shí),反應式則可配平為:4FeS2十11O2=2 Fe2O3十8SO2

代數法——待定系數法
代數法也叫待定系數法。
具體步驟:
1.設a、b、c、d等未知數,分別作為待配平的化學(xué)方程式兩端各項化學(xué)式的系數。
2.根據質(zhì)量守恒定律,反應前后各元素的原子種類(lèi)和個(gè)數必須相等同的原則,列出每種元素的原子數與化學(xué)式系數a、b、c、d……關(guān)系的代數式,這些代數式可聯(lián)立成一待定方程組:
3.解此待定方程組、就可求得各未知數之間的倍數關(guān)系。a=xb=yc=zd=...
4.令某未知數為某一正整數,使其它未知數成為最小正整數,將所得的a、b、c、d等值代入原化學(xué)反應式的待定位置,配平即告完成。
例題
配平Fe2O3十CO→Fe十CO2
(1)設a、b、c、d分別為反應式中各物質(zhì)化學(xué)式的系數:aFe2O3十bCO→cFe十dCO2
(2)依據質(zhì)量守恒定律:反應前后各元素的原子數目必須相等,列出a、b、c、d的關(guān)系式:
對Fe原子有:2a=c①; 對O原子有:3a十b=2d②;對C原于有:b=d③
(3)解①一②的聯(lián)立方程組,可得下列關(guān)系:a=1/3 b=1/2 c=1/3 d
(4)為了使各個(gè)系數成為最小的正整數,而無(wú)公約數,令d=3,則a=1,b=3,c=2。將a、b、c、d的值代人原化學(xué)反應式的相應位置,即得配平的方程式為:Fe2O3十3CO=2Fe十3CO2
(5)別忘了檢驗一下,方程式確已配平了。
須注意的是,只要保證各系數為無(wú)公約數的最小正整數。令b=3或c=2,也可得到相同的配平式。
電子得失法
電子得失法的原理是:氧化一還原反應中,還原劑失去電子的總數必須等于氧化劑獲得電子的總數。根據這一規則,可以配平氧化一還原反應方程式。
具體步驟:
1.從反應式里找出氧化劑和還原劑,并標明被氧化或還原元素的原子在反應前后化合價(jià)發(fā)生變化的情況,以便確定它們的電子得失數。
2.使得失電子數相等,由此確定氧化劑和還原劑等有關(guān)物質(zhì)化學(xué)式的系數。
3.由已得的系數,判定其它物質(zhì)的系數,由此得配平的反應式。
例題
配平金屬銅與濃硝酸起反應的化學(xué)方程式:Cu十HNO3(濃)→Cu(NO3)2十NO2↑十H2O
(1)從反應式看,HNO3為氧化劑,Cu為還原劑。其化合價(jià)的變化和電子得失的情況為:0+5+2+4Cu+HNO3→Cu(NO3)2+NO2+H2O
(2)使電子得失數相等,由此確定以此有關(guān)的物質(zhì)的系數:0+5+2+41Cu十HNO3→1Cu(NO3)2十2NO2十H2O
(3)據此,推斷其它化學(xué)式的系數:反應式右邊生成物多出2個(gè)N原子,故必須在反應式左邊再增加2個(gè)HNO3才可使兩邊的N原子平衡,此時(shí)左邊共有4個(gè)HN03,為使兩邊的氫原子數相等,右邊H2O的系數應配為2,于是得:Cu十4HNO3→Cu(NO3)2十2NO2十2H2O
(4)氧原子未作考慮,但所有系數均已確定了,故還得最后驗證一下,若兩邊的氧原子平衡了,則方程式就可被確認配平。實(shí)際上上式的氧原于已平衡了,故得:Cu十4HNO3=Cu(NO3)2十2NO2↑十2H2O
歸一法
找到化學(xué)方程式中關(guān)鍵的化學(xué)式,定其化學(xué)式前計量數為1,然后根據關(guān)鍵化學(xué)式去配平其他化學(xué)式前的化學(xué)計量數。若出現計量數為分數,再將各計量數同乘以同一整數,化分數為整數,這種先定關(guān)鍵化學(xué)式計量數為1的配平方法,稱(chēng)為歸一法。
做法:選擇化學(xué)方程式中組成最復雜的化學(xué)式,設它的系數為1,再依次推斷。
具體步驟:
1.設NH3的系數為1 1NH3+O2——NO+H2O
2.反應中的N原子和H原子分別轉移到NO和H2O中,
3.由右端氧原子總數推O2系數
舉例
1、FeS2+O2→SO2+Fe2O3
2、Mg+HNO3→Mg(NO3)2+NH4NO3+H2O
3、NH4NO3→N2+O2+H2O
4、FeS+KMnO4+H2SO4→K2SO4+MnSO4+Fe2(SO4)3+H2O+S↓

一、初中化學(xué)方程式的書(shū)寫(xiě)步驟
(1)寫(xiě):正確寫(xiě)出反應物、生成物的化學(xué)式
(2)配:配平化學(xué)方程式
(3)注:注明反應條件
(4)標:如果反應物中無(wú)氣體(或固體)參加,反應后生成物中有氣體(或固體),在氣體(或固體)物質(zhì)的化學(xué)式右邊要標出“↑”(或“↓”).若有氣體(或固體)參加反應,則此時(shí)生成的氣體(或固體)均不標箭頭,即有氣生氣不標“↑”,有固生固不標“↓”
二、根據初中化學(xué)方程式進(jìn)行計算的步驟
(1)設:根據題意設未知量
(2)方:正確書(shū)寫(xiě)有關(guān)化學(xué)反應方程式
(3)關(guān):找出已知物、待求物的質(zhì)量關(guān)系
(4)比:列出比例式,求解
(5)答:簡(jiǎn)要的寫(xiě)出答案

三、根據初中化學(xué)方程式進(jìn)行計算的步驟
最小公倍數法
本法也是配平化學(xué)反應方程式慣用的方法,通常用于較簡(jiǎn)單的化學(xué)方程式的配平,或者作為配平復雜反應的輔助方主。
運用此法一般可按下述步驟去進(jìn)行:
具體步驟:
1.首先,找出反應式左右兩端原子數最多的某一只出現一次的元素,求出它們的最小公倍數。
2,其次,將此最小公倍數分別除以左右兩邊原來(lái)的原子數,所得之商值,就分別是它們所在化學(xué)式的系數。
3.然后,依據已確定的物質(zhì)化學(xué)式的系數、推導并求出它化學(xué)式的系數,直至將方程式配平為止。
4.最后,驗證反應式。配平是否正確。
例題
試配平磁鐵礦(Fe3O4)與鋁粉共燃的反應方程Fe3O4十Al→Fe十Al2O3
(1)該反應氧原子數較多且在兩邊只出現一次,故先求出兩邊氧原子數的最小公倍數:4×3=12。
(2)根據質(zhì)量守恒定律,要使反應式左右兩邊的氧原子數相等,Fe3O4的系數必須為3(12/4),AI2O3的系數必須為4(12/3)即:3Fe3O4十A1→Fe十4A12O3
(3)再配Fe和AL原子。由已配得的3Fe3O4和4Al2O3可知,Fe和Al的系數分別為9和8時(shí),左右兩邊的Fe和Al的原子數才相等,故有:3Fe3O4+8Al=9Fe+4Al2O3
(4)最后檢驗,得完整的化學(xué)方程式為:3Fe3O4+8A=9Fe+4Al2O3
奇數配偶數法
用奇數配偶數法去配平化學(xué)反應方程式的原理是:
一、兩個(gè)奇數或兩個(gè)偶數之和為偶數;奇數與偶數之和則為奇數——簡(jiǎn)稱(chēng)加法則。奇數與偶數或兩個(gè)偶數之積為偶數;兩個(gè)奇數之積則仍為奇數——簡(jiǎn)稱(chēng)乘法則。
二、依質(zhì)量守恒定律,反應前后各元素的原子總數相等。
其配平方法可按以下步驟進(jìn)行:
具體步驟:
1.找出化學(xué)反應式左右兩邊出現次數較多的元素,且該元素的原子個(gè)數在反應式左右兩邊有奇數也有偶數;
2.選定含該元素奇數個(gè)原子的化學(xué)式,作為配乎起點(diǎn),選配適當系數,使之偶數化;
3.由已推得的系數,來(lái)確定其它物質(zhì)的系數。
4.最后,驗證方程式是否正確。
例題
配平FeS2十O2→Fe2O3十SO2
(1)從反應方程式可知,氧元素在兩邊出現的次數較多,且其原子個(gè)數在兩邊有奇數亦有偶數。
(2)反應式左邊有O2,由“乘法則”可知,其系數無(wú)論為何,O原子總數必為偶,而由“加法則”可知,要使右邊O原子總數亦為偶,就必須給右邊含奇數個(gè)氧原子的Fe2O3系數選配2,使之偶數化,則:FeS2十O2→2 Fe2O3十SO2
(3)由已確定的系數,推出與此有關(guān)的其它物質(zhì)的系數。反應式右邊有4個(gè)Fe原子,故左邊FeS2的系數須配4,則:4FeS2十O2→2 Fe2O3十SO2,然后以左邊的S原子數,推得右邊應有8SO2,即:4FeS2十O2→2 Fe2O3十8SO2,最后配平O原子,當左邊有11O2時(shí),反應式則可配平為:4FeS2十11O2=2 Fe2O3十8SO2

代數法——待定系數法
代數法也叫待定系數法。
具體步驟:
1.設a、b、c、d等未知數,分別作為待配平的化學(xué)方程式兩端各項化學(xué)式的系數。
2.根據質(zhì)量守恒定律,反應前后各元素的原子種類(lèi)和個(gè)數必須相等同的原則,列出每種元素的原子數與化學(xué)式系數a、b、c、d……關(guān)系的代數式,這些代數式可聯(lián)立成一待定方程組:
3.解此待定方程組、就可求得各未知數之間的倍數關(guān)系。a=xb=yc=zd=...
4.令某未知數為某一正整數,使其它未知數成為最小正整數,將所得的a、b、c、d等值代入原化學(xué)反應式的待定位置,配平即告完成。
例題
配平Fe2O3十CO→Fe十CO2
(1)設a、b、c、d分別為反應式中各物質(zhì)化學(xué)式的系數:aFe2O3十bCO→cFe十dCO2
(2)依據質(zhì)量守恒定律:反應前后各元素的原子數目必須相等,列出a、b、c、d的關(guān)系式:
對Fe原子有:2a=c①; 對O原子有:3a十b=2d②;對C原于有:b=d③
(3)解①一②的聯(lián)立方程組,可得下列關(guān)系:a=1/3 b=1/2 c=1/3 d
(4)為了使各個(gè)系數成為最小的正整數,而無(wú)公約數,令d=3,則a=1,b=3,c=2。將a、b、c、d的值代人原化學(xué)反應式的相應位置,即得配平的方程式為:Fe2O3十3CO=2Fe十3CO2
(5)別忘了檢驗一下,方程式確已配平了。
須注意的是,只要保證各系數為無(wú)公約數的最小正整數。令b=3或c=2,也可得到相同的配平式。
電子得失法
電子得失法的原理是:氧化一還原反應中,還原劑失去電子的總數必須等于氧化劑獲得電子的總數。根據這一規則,可以配平氧化一還原反應方程式。
具體步驟:
1.從反應式里找出氧化劑和還原劑,并標明被氧化或還原元素的原子在反應前后化合價(jià)發(fā)生變化的情況,以便確定它們的電子得失數。
2.使得失電子數相等,由此確定氧化劑和還原劑等有關(guān)物質(zhì)化學(xué)式的系數。
3.由已得的系數,判定其它物質(zhì)的系數,由此得配平的反應式。
例題
配平金屬銅與濃硝酸起反應的化學(xué)方程式:Cu十HNO3(濃)→Cu(NO3)2十NO2↑十H2O
(1)從反應式看,HNO3為氧化劑,Cu為還原劑。其化合價(jià)的變化和電子得失的情況為:0+5+2+4Cu+HNO3→Cu(NO3)2+NO2+H2O
(2)使電子得失數相等,由此確定以此有關(guān)的物質(zhì)的系數:0+5+2+41Cu十HNO3→1Cu(NO3)2十2NO2十H2O
(3)據此,推斷其它化學(xué)式的系數:反應式右邊生成物多出2個(gè)N原子,故必須在反應式左邊再增加2個(gè)HNO3才可使兩邊的N原子平衡,此時(shí)左邊共有4個(gè)HN03,為使兩邊的氫原子數相等,右邊H2O的系數應配為2,于是得:Cu十4HNO3→Cu(NO3)2十2NO2十2H2O
(4)氧原子未作考慮,但所有系數均已確定了,故還得最后驗證一下,若兩邊的氧原子平衡了,則方程式就可被確認配平。實(shí)際上上式的氧原于已平衡了,故得:Cu十4HNO3=Cu(NO3)2十2NO2↑十2H2O
歸一法
找到化學(xué)方程式中關(guān)鍵的化學(xué)式,定其化學(xué)式前計量數為1,然后根據關(guān)鍵化學(xué)式去配平其他化學(xué)式前的化學(xué)計量數。若出現計量數為分數,再將各計量數同乘以同一整數,化分數為整數,這種先定關(guān)鍵化學(xué)式計量數為1的配平方法,稱(chēng)為歸一法。
做法:選擇化學(xué)方程式中組成最復雜的化學(xué)式,設它的系數為1,再依次推斷。
具體步驟:
1.設NH3的系數為1 1NH3+O2——NO+H2O
2.反應中的N原子和H原子分別轉移到NO和H2O中,
3.由右端氧原子總數推O2系數
舉例
1、FeS2+O2→SO2+Fe2O3
2、Mg+HNO3→Mg(NO3)2+NH4NO3+H2O
3、NH4NO3→N2+O2+H2O
4、FeS+KMnO4+H2SO4→K2SO4+MnSO4+Fe2(SO4)3+H2O+S↓
相關(guān)文章:
- [初中化學(xué)]初中化學(xué)復習方法大全_如何系統復習初中化學(xué)
- [初中化學(xué)]初三化學(xué)期末復習方法及備考攻略
- [初中化學(xué)]初三化學(xué)學(xué)習方法與技巧_快速提高初中化學(xué)成績(jì)攻略
- [初中化學(xué)]初三化學(xué)學(xué)習方法匯總整理_怎樣提高化學(xué)中考成績(jì)
- [初中化學(xué)]學(xué)好化學(xué)的幾個(gè)小竅門(mén)_怎樣夯實(shí)初中化學(xué)基礎
- [初中化學(xué)]如何制定合理的化學(xué)學(xué)習計劃?
- [初中化學(xué)]初中生快速提高化學(xué)成績(jì)的方法和要素
- [初中化學(xué)]五種提高初中化學(xué)成績(jì)的基本方法
- [初中化學(xué)]學(xué)好初中化學(xué)的五個(gè)秘訣和六個(gè)步驟
- [初中化學(xué)]快速提高化學(xué)成績(jì)的方法及攻略
- [初中化學(xué)]化學(xué)方程式書(shū)寫(xiě)計算步驟及配平技巧大全
- [初中化學(xué)]初三化學(xué)復習策略及做題方法
- [初中化學(xué)]學(xué)好化學(xué)基礎知識方法大全
- [初中化學(xué)]學(xué)好化學(xué)要分四步走
今日推薦

